Para que un metabolismo sea eficiente debe utilizar con eficacia los diferentes sustratos energéticos, de tal forma que se utilizará con preferencia los ácidos grasos en los momentos de inactividad física o de ayuno, mientras que la glucosa será consumida principalmente en los momentos de ingesta, previa estimulación insulínica, o durante la actividad física de moderada a alta intensidad .
Para conocer el sustrato preferencial utilizado en ayunas se puede se puede emplear el cociente respiratorio (CR) que es el CO2 producido con respecto al O2 consumido (CR=VCO2/VO2), de tal forma que un valor próximo a 0,7 mostrará una mayor utilización de las grasas como sustrato energético, y valores cercanos a 1 indicará, por contra, mayor consumo de hidratos de carbono.

La determinación del CR es importante para saber con exactitud no sólo el combustible utilizado preferencialmente, sino para hacerse una idea del funcionamiento de nuestro metabolismo en general. Si durante los momentos de ayunos el cuerpo utiliza prioritariamente los ácidos grasos tendremos menor acumulación de intermediarios lipídicos en tejidos no adiposos como puede ser el musculo esquelético o hepático; esto es importante porque mantendremos una alta sensibilidad a la insulina, lo que supondrá un mejor y rápido relleno de los depósitos de glucógeno. Pero si, por contra, nuestro organismo consume glucosa en ayunas, estará impidiendo que los ácidos grasos entren en la mitocondria para su oxidación, lo que dará lugar a una mayor acumulación de lípidos, tanto en el tejido adiposo como fuera de este, donde podrían depositarse como ceramidas, diacilgliceroles o ácidos grasos acilados en las células musculares, hepáticas o pancreáticas causando resistencia a la insulina. Es por este motivo que la posterior estimulación insuliníca tampoco conseguiría elevar la tasa de utilización de la glucosa, mostrándose, en el gráfico que mide el CR, un encefalograma plano. Pero este menor relleno de glucógeno muscular limitará tanto la capacidad de ayunar, como la intensidad y duración de los entrenamientos efectuados, facilitando con ello las posibilidades de sobreentrenamiento.
Podemos determinar de este modo que la resistencia a la insulina es un estado de inflexibilidad metabólica que procurará con el tiempo la aparición del resto de condiciones que refleja el síndrome metabólico.
¿Qué es lo que puede ocurrir en nuestro organismo para que se pierda ese estado de flexibilidad metabólica?. Si tuviese que señalar a un culpable sin duda diría la inflamación. Esta puede venir de varios sitios:
- En primer lugar, de los intestinos; efectivamente, una alteración de nuestra microbiota intestinal puede producir un daño en nuestra mucosa, y esto a su vez ser un foco de inflamación, lo que segregará sin duda una serie de citoquinas inflamatorias como puede ser la interleuquina 6 (IL-6), y el factor de necrosis tumoral alfa (TNF-α ). De estas dos citoquinas, la que parece más responsable de la disminución de la sensibilidad a la insulina es el TNF-α . Mientras que La IL-6 parece ejercer un papel importante en el metabolismo de los ácidos grasos, aumentando las tasas de oxidación y la atenuación de la lipogénesis mediada por la insulina, el TNF-α a pesar de no tener un efecto concreto sobre las oxidación de ácidos grasos, sí que aumenta la incorporación de diacilgliceroles en la célula, lo que sin duda disminuye la sensibilidad a la insulina (aquí).
- En segundo lugar, la expansión de nuestro tejido adiposo. El exceso de calorías y/o dietas inapropiadas, pueden dar lugar al aumento del tejido adiposo algo que sin duda generará una serie de adipoquinas y un aumento de la infiltración de los macrófagos en este tejido, con un resultado similar al anterior, es decir, la liberación de citoquinas pro-inflamatorias como la IL-6 o el TNF-α
Pero una mutación defectuosa de este gen producirá una acumulación de lípidos intracelulares. En la siguiente fotografía se puede observar este aumento (en verde), lo que propiciará la pérdida de sensibilidad a la insulina, una reducida función mitocondrial y el aumento del estrés oxidativo (aquí)
Pero la pregunta que cabe hacerse ahora, es ¿por qué se produce una alteración de este gen?, la respuesta no es sencilla, pero se sugiere que podría ser el resultado de la METILACIÓN . ¡Vale!, y ¿qué es eso de la metilación?, podemos decir que es el principal mecanismo epigenético que puede modificar la actividad del ADN pero sin alterar su secuencia, Es decir, una interacción entre los genes de un organismo y el ambiente, de tal forma que muchos podrán ser silenciados y otros activados, dando lugar a una infinidad de procesos fisiológicos y patológicos. Pero para entender completamente qué es la metilación y su capacidad de regular la transcripción de genes es necesario hablar de la homocisteína
 La homocisteína es un aminoácido azufrado que no está presente en al dieta sino que se forma de manera exclusiva como un producto intermediario de la transformación de la metionina en cisteína, para ello se requiere la enzima metionina adenosiltransferasa (MAT), que convierte la metionina en S-adenosilmetionina (SAM) y que es el principal donante de grupos metilos (entre los que quiero destacar la metilación del ADN que veremos más tarde). Una vez formada, la homocisteína, puede tomar dos vías diferentes o bien es reciclada nuevamente a metionina por un proceso de remetilación (requiere ácido fólico y B12) o bien prosigue su transformación de manera irreversible, hasta la formación de CISTEÍNA (requiere B6)que será precursora de nuevas proteínas o del antioxidante glutatión. Generalmente existe un equilibrio entre su formación y reciclaje o eliminación, pero cuando hay una mayor producción en relación a su consumo , las células lo excretan aumentando la concentración en plasma. Y es este exceso de homocisteína la que podría estar detrás del desarrollo de enfermedades cardiovasculares o del daño neuronal (aquí)(aquí)(aquí), siendo de vital importancia la presencia de vitaminas del grupo B, para que estos procesos tengan lugar y eviten el aumento de homocisteína.
La homocisteína es un aminoácido azufrado que no está presente en al dieta sino que se forma de manera exclusiva como un producto intermediario de la transformación de la metionina en cisteína, para ello se requiere la enzima metionina adenosiltransferasa (MAT), que convierte la metionina en S-adenosilmetionina (SAM) y que es el principal donante de grupos metilos (entre los que quiero destacar la metilación del ADN que veremos más tarde). Una vez formada, la homocisteína, puede tomar dos vías diferentes o bien es reciclada nuevamente a metionina por un proceso de remetilación (requiere ácido fólico y B12) o bien prosigue su transformación de manera irreversible, hasta la formación de CISTEÍNA (requiere B6)que será precursora de nuevas proteínas o del antioxidante glutatión. Generalmente existe un equilibrio entre su formación y reciclaje o eliminación, pero cuando hay una mayor producción en relación a su consumo , las células lo excretan aumentando la concentración en plasma. Y es este exceso de homocisteína la que podría estar detrás del desarrollo de enfermedades cardiovasculares o del daño neuronal (aquí)(aquí)(aquí), siendo de vital importancia la presencia de vitaminas del grupo B, para que estos procesos tengan lugar y eviten el aumento de homocisteína.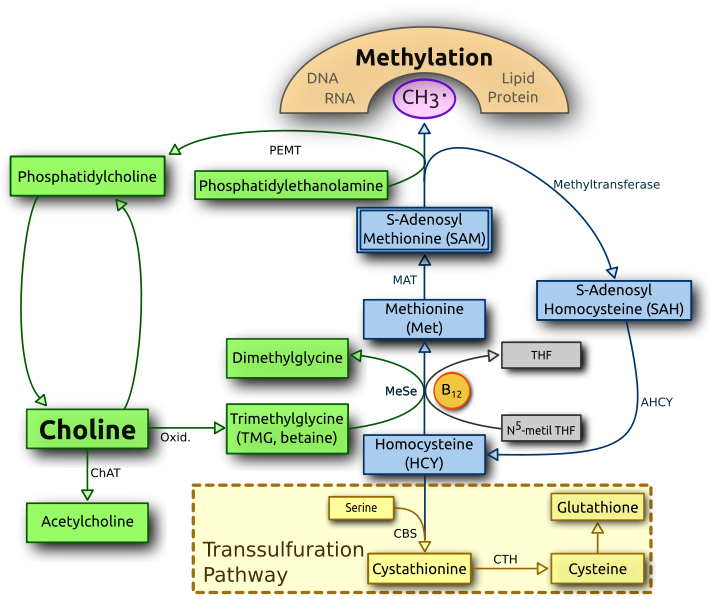
La células cancerígenas pueden presentar tanto una hipometilación como una hipermetilación, la primera activando genes que favorecen la expansión del tumor y la segunda reprimiendo los genes supresores de tumores. El mencionado gen BRCA1, es en definitiva un gen supresor de tumores, que producto de la hipermetilación muta dejando de efectuar su labor (explicado de manera sencilla).
Ahora es cuando no metemos en terreno pantanoso, y las explicaciones lo máximo que pueden alcanzar son teorías.
Cómo siempre es una cuestión de equilibrio, creo que faltan muchas respuestas, y todas estas cuestiones están abiertas a la especulación y el debate..., quizás lo más sensato sería llevar una alimentación altamente nutritiva (y cierta actividad física), rica en alimentos del grupo B y colina, porque tal vez los suplementos no sean lo más adecuado (lo digo con todas las reservas). Seguiremos hablando de este asunto y el gen que posiblemente regule la flexibilidad metabólica, BRCA1

Como siempre, interesantísimos tus artículos, recientemente ha llegado a mis manos información muy interesante relacionada con el metabolismo y el sistema hormonal y la cascada cortisol-inflamación-tiroides-estrógenos-ác.grasos insaturados... Que rompe bastante con la moda low carb, anti-azúcar, fructosa, la moda de los suplementos de omega 3 y me está aclarando bastantes cosas, a ver qué opinión te merece (perdona por el tocho de información :p):
ResponderEliminarhttp://raypeat.com/articles/
http://www.dannyroddy.com/articles/
http://www.functionalps.com/blog/category/general/
Un saludo.
Luisa.
¡Hola Luisa!, muchas gracias por tus enlaces, he mirado por encima el primero, y hay muchísima información..., voy a intentar echar un vistazo a todos, y te comento.
ResponderEliminar¡Un saludo!